Cause dei calcoli renali (testo con alcuni contenuti sponsorizzati)
Vi sono particolari tipi di individui che hanno una elevata predisposizione a formare calcoli renali. Questi individui vengono definiti con termine inglese “stone formers”, ossia individui formanti calcoli.
Nella maggior parte dei casi è possibile riconoscere negli stone formers specifiche alterazioni metaboliche e/o anomalie anatomiche, che, se diagnosticate correttamente, consentono di impostare una giusta terapia e prevenire la formazione di calcoli ai reni.
I processi chimico-fisici che portano alla formazione dei calcoli renali comprendono una cascata di eventi che si verifica quando il filtrato glomerulare attraversa il nefrone. Alla base del processo vi è la sovra saturazione dell’urina ai sali formanti calcoli. Questi sali o molecole precipitano nell’ urina e diventano nuclei o cristalli. Una volta formatisi, i cristalli possono defluire nelle basse vie urinarie o rimanere nel rene agganciandosi a siti di ancoraggio che ne determinano la crescita ed aggregazione in calcoli.
Una soluzione acquosa viene definita satura quando viene raggiunta la massima concentrazione di sali in essa dissolubili. Se ad una soluzione statura viene aggiunta una ulteriore quantità di sali, questi precipitano. Il grado di saturazione di una soluzione contenente acqua e ioni dipende anche dal pH e dalla temperatura.
Nel caso delle urine, anche se si verifica una precipitazione dei sali potenziali responsabili di calcolosi (come ad esempio l’ossalato di calcio), non necessariamente si arriva alla formazione dei calcoli ai reni. Infatti, l’urina è provvista di sostanze che inibiscono la formazione di calcoli e che consentono una ulteriore concentrazione di sali. Quando l’urina diventa sovra satura per la presenza di sali formanti calcoli viene definita “metastabile”. La terapia metabolica e la prevenzione dei calcoli renali è particolarmente utile proprio quando la concentrazione di urina si trova in questa fase metastabile. L’ossalato di calcio è quattro volte più solubile nelle urine che nell’acqua.
I fattori urinari che favoriscono la formazione dei calcoli sono:
- Diminuzione della diuresi (oliguria)
- Riduzione della concentrazione di citrati (ipocitraturia)
- Aumento della concentrazione di calcio nelle urine (ipercalciuria)
- Aumento della concentrazione di ossalato nelle urine (iperossalaturia)
- Aumento della concentrazione di fosfato nelle urine (iperfosfaturia)
- Aumento della concentrazione di acido urico nelle urine (iperuricosuria)
Le sostanze che inibiscono la formazione dei calcoli sono:
- Citrato di potassio e di magnesio
- Nefrocalcina
- Uropontina
- Proteina di Tamm-Horsfall
Il citrato inibisce la formazione dei calcoli di ossalato di calcio e di fosfato di calcio agendo su vari meccanismi. Innanzitutto, il citrato ha la capacità di legarsi al calcio limitando la disponibilità di questo ione, dalla cui interazione con ossalato e fosfato si determina la formazione del calcolo.
In secondo luogo, inibisce con meccanismo diretto la precipitazione dell’ossalato di calcio e previene l’aggregazione dei cristalli di questo sale. Inoltre, il citrato possiede una potente azione nella inibizione della crescita dei cristalli di fosfato di calcio. Il magnesio, legandosi all’ ossalato, ne riduce la disponibilità e previene la sovra saturazione dell’ossalato di calcio nelle urine.
Un recente studio ha dimostrato che il magnesio in vitro riduce il tempo di contatto tra le molecole di calcio e di ossalato. La nefrocalcina e la proteina di Tamm-Horsfall sono due glicoproteine urinarie che esplicano una potente azione inibitoria sull’ aggregazione dei cristalli di ossalato di calcio monoidrato. L’uropontina inibisce la nucleazione, la crescita e l’aggregazione dei cristalli di ossalato di calcio e l’attaccamento dei cristalli con l’epitelio renale.
Classificazione (torna su)
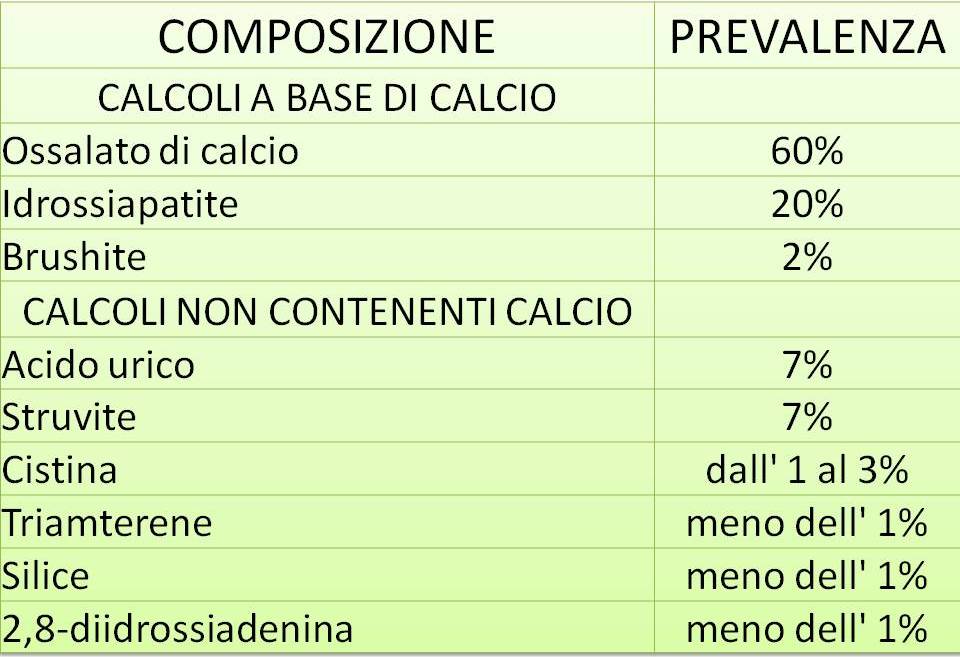
I calcoli renali vengono di solito classificati in base alle sostanze di cui sono formati. I calcoli di gran lunga più frequenti sono quelli composti da calcio che rappresentano l’80% dei casi. Nell’ambito dei calcoli contenenti calcio, quelli di ossalato di calcio sono il 60% del totale, i calcoli misti di ossalato di calcio e di idrossiapatite costituiscono il 20% mentre i calcoli di brushite il 2% dei casi.
I calcoli di acido urico e di struvite hanno ciascuno una prevalenza del 7% del totale. I calcoli meno frequenti sono quelli di cistina (solo l’1%) e i calcoli formantisi per l’assunzione di particolari tipi di farmaci.
I calcoli renali possono inoltre essere classificati in base all’ alterazione metabolica che li ha determinati. Queste alterazioni possono essere presenti singolarmente o in maniera concomitante.
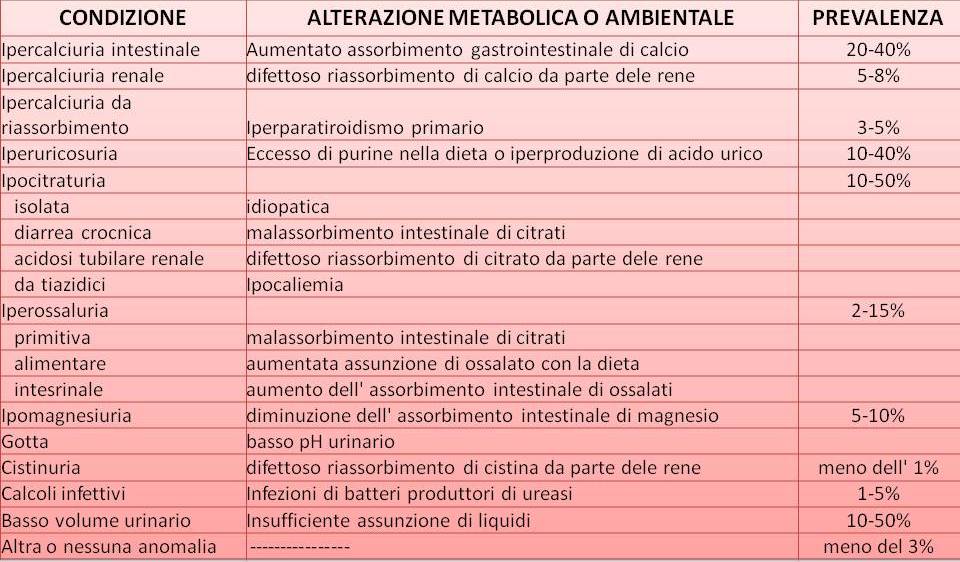
I disordini del metabolismo che possono portare alla formazione dei calcoli renali sono i seguenti:
- Ipercalciuria (aumento di calcio nelle urine)
- Iperuricosuria (aumeno di acido urico nelle urine)
- Ipocitraturia (diminuzione del citrato nelle urine)
- Iperossaluria (aumento di ossalati nelle urine)
- Ipomagnesiuria (riduzione di magnesio nelle urine)
- Cistinuria (presenza di cistina nelle urine)
- Infezioni
- Oliguria (riduzione del volume urinario)
Andiamo adesso a considerare nei dettagli le potenziali cause dei calcoli al rene.
Ipercalciuria (torna su)
Si definisce ipercalciuria l’aumento di calcio nelle urine. L’ipercalciuria è l’alterazione metabolica di più frequente riscontro negli stone-former (termine inglese che descrive individui con una particolare predisposizione alla produzione dei calcoli).
Il criterio maggiormente adottato per definire questa alterazione è la secrezione nelle urine di un quantitativo di calcio superiore ai 200 mg dopo avere osservato per una settimana una dieta a base di 400 mg di calcio e di 100 mg di sodio. Tuttavia, questo valore soglia di 200 mg per distinguere la ipercalciuria dalla normocalciuria è puramente artificiale.
Distinguiamo tre tipi di meccanismi che generano la ipercalciuria:
- Ipercalciuria da assorbimento intestinale
- Ipercalciuria renale
- Iperacalciuria da riassorbimento osseo
L’ipercalciuria da assorbimento intestinale è causata da un eccesso di calcio nella dieta. L’aumentato assorbimento di calcio con la dieta tramite l’intestino determina un aumento transitorio di calcio nel sangue (ipercalcemia). L’ipercalcemia sopprime la produzione del paratormone, ormone prodotto dalle ghiandole paratiroidi. La soppressione del paratormone provoca una riduzione del riassorbimento del calcio da parte dei reni ed un aumento di calcio nelle urine. Una ipercalciuria intestinale può dipendere anche da alterazione del metabolismo della vitamina D.
L’ipercalciuria di origine renale dipende da un difetto da parte del rene di riassorbire il calcio. In condizioni normali i reni riassorbono il 98% del calcio filtrato dal sangue. Patologie congenite e/o acquisite del rene sono potenziali cause di ipercalciuria renale.
L’ipercalciuria da riassorbimento è causata da un aumentato rilascio di calcio dalle ossa. Un adenoma paratiroideo secernente è una causa di questo tipo di ipercalciuria. Questa patologia determina infatti un aumento di secrezione del paratormone (iperparatiroidismo). Un’aumentata secrezione di paratormone da parte delle paratiroidi è causa di un aumento di calcio sia nel sangue che nelle urine.
Questo avviene perché il paratormone aumenta i livelli di calcemia sia stimolando l’assorbimento intestinale di questo elemento sia il suo rilascio da parte del sistema scheletrico. Altre cause di ipercalciuria da riassorbimento sono i tumori, la sarcoidosi, la tirotossicosi e la tossicità alla vitamina D. Alcune malattie definite granulomatose come la tubercolosi e la sarcoidosi, aumentano la produzione del calcitriolo, la forma attiva della vitamina D3.
I tumori che possono provocare ipercalciuria da riassorbimento sono le neoplasie maligne del polmone, della mammella, del rene, della testa, del collo e del sangue (linfomi e mielomi). Questi tumori possono provocare un danno diretto alle ossa con conseguente immissione nel sangue di calcio, oppure producono una proteina con un meccanismo di azione simile a quello del paratormone. Anche i glicocorticoidi possono aumentare i livelli di calcio tramite una stimolazione del paratormone: ciò si verifica sia durante una terapia a base di cortisone che nel morbo di Cushing.
Iperossaluria (torna su)
Si definisce iperossaluria una secrezione di ossalato con le urine maggiore di 40 mg al giorno. Questa alterazione metabolica può causare la precipitazione di calcoli di ossalato di calcio.
Esistono tre tipi di iperossaluria:
- Iperossaluria primitiva
- Iperossaluria alimentare
- Iperossaluria intestinale
L’iperossaluria primitiva è determinata da un’aumentata produzione di ossalato da parte dell’organismo. È una rara patologia genetica di tipo autosomico recessivo caratterizzata da varie mutazioni enzimatiche che provocano un accumulo di glicosilato. Il glicosilato in eccesso viene convertito in ossalato dal metabolismo.
L’iperossaluria primitiva viene a sua volta suddivisa in tre tipologie:
1) iperossaluria primitiva di tipo 1 è causata dalla mutazione del gene che codifica per l’enzima AGT (alanina-glicosilato aminotrasferasi). Questo tipo di enzima che si trova nelle cellule epatiche è coinvolto nei processi di depurazione delle sostanze tossiche per l’organismo e nel metabolismo di alcuni tipi di grassi. L’AGT scompone il glicosilato nella glicina. Il gene AGXT può essere affetto da quasi 100 diversi tipi di mutazione che hanno come risultato ultimo un aumento di ossalato nelle urine tramite un accumulo di glicosilato che, invece di essere convertito in glicina, viene trasformato in ossalato. L’eccesso di ossalato viene filtrato dai reni nelle urine e, precipitando, provoca la formazione di calcoli di ossalato di calcio.
2) iperossaluria primitiva di tipo 2 dipende da una mutazione del gene GRHPR che fornisce informazioni per la sintesi dell’enzima glicosilato/idrossipiruvato reduttasi. Questo enzima converte il glicosilato in glicato. Un malfunzionamento di questo enzima è una ulteriore causa di accumulo di glicosilato e di conseguente eccesso di ossalati.
3) iperossaluria primitiva di tipo 3 è determinata da mutazione in un altro gene coinvolto nel metabolismo del glicosilato, il gene HOGA1. Questo gene codifica per l’ enzima 4-idrossi-2-ossoglutarato (HOGA) che trasforma il glicosilato in piruvato. Anche questo tipo di mutazione, come le due precedenti, provoca un aumento della conversione di glicosilato in ossalato.
L’iperossaluria di tipo alimentare dipende da un’aumentata assunzione di ossalati con la dieta. I cibi che tipicamente sono ricchi di ossalati sono i seguenti:
- noci
- cioccolato
- the a foglia larga
- spinaci
- patate
- barbabietole
- rabarbaro
La quota di ossalato urinario secreta nelle urine che proviene dalla dieta varia tra il 24% ed il 42%. Anche una drastica riduzione dell’assunzione di calcio tramite l’alimentazione può portare ad un aumento dell’assorbimento di ossalati da parte dell’intestino. Anche la vitamina C (acido ascorbico), se assunta in dosi eccessiva, viene convertita in ossalato dall’intestino.
L’iperossalluria intestinale è causata da un aumento dell’assorbimento di ossalati da parte dell’intestino. Questa forma di iperossaluria è una patologia acquisita, a differenza della iperossaluria primitiva che invece è di origine genetica. Questa alterazione è associata alle patologie che causano diarrea frequente. La diarrea cronica infatti provoca un malassorbimento e saponificazione degli acidi grassi con conseguente accumulo intestinale di calcio e magnesio.
L’eccesso di questi due ioni bivalenti nell’ intestino provoca un aumentato assorbimento di ossalati. Tutte le patologie che causano diarrea e malassorbimento di acidi grassi possono provocare un aumento degli ossalati. Esempi tipici di questo tipo di malattie sono la celiachia, il morbo di Chron e le infezioni intestinali da parte di parassiti. Anche interventi di chirurgia bariatrica (chirurgia per l’obesità patologica) come il by-pass gastrico provocano uno stato di malassorbimento indotto e sono potenziali causa di aumentato assorbimento intestinale di ossalati.
Iperuricosuria (testo con alcuni contenuti sponsorizzati) (torna su)
Una condizione di iperuricosuria (anche detta “iperuricuria) si instaura quando la concentrazione di acido urico nelle urine supera i 600mg al giorno. Normalmente i livelli di uricosuria vengono valutati sulle urine raccolte nell’arco delle 24 ore. L’acido urico viene normalmente prodotto nell’ organismo come prodotto della degradazione delle purine, gli elementi che costituiscono il DNA delle cellule.
L’acido urico può essere sia di origine endogena, nella forma di prodotto della degradazione delle cellule dell’organismo, sia di origine esogena, introdotto con l’alimentazione di cibi sia di derivazione animale che vegetale. L’iperuricosuria è una condizione predisponente sia per i calcoli di ossalato di calcio che per quelli di acido urico. Questa alterazione metabolica è presente nel 10% degli individui che formano calcoli a base di calcio come condizione isolata e, nel 40% dei casi, in associazione ad altre patologie.
Il meccanismo attraverso cui l’iperuricuria induca la formazione di calcoli di ossalato di calcio non è ancora completamente chiarito. Si ipotizza che un aumento di acido urico nelle urine elevi la concentrazione urinaria di urato monosodico che a sua volta induce la formazione dei calcoli di ossalato di calcio tramite un processo di nucleazione eterogenea.
La causa più comune di iperuricosuria è l’elevata assunzione di purine tramite la dieta. Gli alimenti particolarmente ricchi di purine includono i seguenti:
- interiora (cervello, fegato, rognone)
- carne rossa
- selvaggina
- alcuni pesci (sardine, aringhe, capesante)
Vi sono anche patologie, sia ereditarie che acquisite, che elevano l’acido urico nelle urine.
Tali patologie sono le seguenti:
- gotta
- patologie mielo e linfoproliferative
- mieloma multiplo
- policitemia secondaria
- anemia perniciosa
- malattie emolitiche
- emoglobinopatie
- talassemie
- deficit parziale o completo di HGPRT
- diarrea cronica
I calcoli di acido urico si formano quando vi è la concomitanza di tre situazioni:
- a) iperuricosuria
- b) pH urinario acido
- c) oliguria (basso volume urinario)
L’ acido urico è un acido debole, che, ad un livello di pH di 5,35 è presente nelle urine per la metà sotto forma di acido urico e per l’altro 50% sotto forma di sale sodico. Il sale sodico è molto più solubile rispetto all’ acido urico. Pertanto la solubilità dell’acido urico aumenta in condizione di urine alcaline (con pH elevati) e diminuisce in condizione di acidità urinaria (pH bassi). Questo è molto importante per la prevenzione dei calcoli da ipeuricosuria: gli stone formers con livelli elevati di acido urico dovrebbero alcalinizzare le urine tramite l’assunzione di integratori alimentari a base di citrato di potassio come il breaston.
Un altro accorgimento importante è limitare l’assunzione di cibi ricchi di purine e limitare il consumo di alcolici. Altra misura terapeutica consiste nella assunzione di farmaci in grado di ridurre la concentrazione di acido urico nel sangue (Febuxostat, Allopurinolo, Oxipurinolo, Tisopurinolo). Se l’acido urico ha una concentrazione normale nelle urine ed elevata nel sangue, è possibile la prescrizione di farmaci che stimolano la secrezione urinaria di acido urico (farmaci uricosurici) come il probenecid o il sulfinpirazone. Tali farmaci riducono la concentrazione di acido urico nel sangue e ne aumentano la eliminazione con le urine.
Ipocitraturia (torna su)
L’ipocitraturia è una frequente alterazione metabolica alla base della eziologia della calcolosi. Oltre ad essere frequente è anche facilmente correggibile. Si stima che l’ipocitraturia sia presente come condizione isolata nel 10% dei casi di calcoli a base di calcio e nel 20-60% dei casi associata ad altre alterazione metaboliche. Come scritto in precedenza, il citrato è un potente inibitore della formazione di calcoli.
L’ipocitraturia si instaura quando la concentrazione di citrati nelle urine nelle 24 ore è inferiore ai 320 mg. L’escrezione urinaria di citrato è strettamente connessa con il mantenimento dell’equilibrio dello stato acido-base. Una condizione di acidosi metabolica riduce la citraturia tramite un aumento del riassorbimento renale.
Le patologie che causano acidosi metabolica (potenziali causa di ipocitraturia) sono le seguenti:
- acidosi tubulare renale
- diarrea cronica
- dieta a base di un eccessivo consumo di proteine animali
- farmaci (diuretici tiazidici, ACE inibitori)
- intensa attività fisica (tramite aumentata produzione di acido lattico)
I fattori invece che aumentano la concentrazione di citrati nelle urine includono:
- alcalosi metabolica
- iperparatiroidismo
- estrogeni
- magnesio
- calcitonina
- vitamina D
Acidita’ Urinaria (Basso Ph Urinario) (torna su)
Quando le urine sono acide (pH inferiore a 5,5), l’acido urico è presente in concentrazioni superiori nella sua forma indissociata, costituendo un fattore di rischio per la formazione di calcoli sia di ossalato di calcio che di acido urico. Pertanto, qualsiasi patologia che riduce il pH urinario è una potenziale causa di calcolosi. L’acidosi metabolica cronica provoca acidità urinaria, ipercalciuria ed ipocitraturia.
Acidosi Tubulare Renale (torna su)
L’acidosi tubulare renale è una patologia caratterizzata da acidosi metabolica. Può dipendere sia da un difetto nella secrezione di ioni idrogeno che da un alterato riassorbimento dei bicarbonati. Esistono tre tipi di acidosi tubulare renale.
L’acidosi tubulare renale di tipo 1, dipende da un’alterazione della secrezione renale di ioni idorgeno; il tipo 2 è causato da un deficit nel riassorbimento del bicarbonato; il tipo 4 invece è determinato da anomalie nella sintesi o nella risposta all’aldosterone.
I pazienti affetti da acidosi tubulare renale possono non lamentare alcun disturbo, soffrire di sintomi dipendenti da alterazioni nel metabolismo degli elettrolitici o essere affetti da una malattia renale cronica. L’acidosi tubulare renale cronica è spesso caratterizzata da un danno strutturale dei tubuli renali.
Ipomagnesuria (torna su)
L’ipomagnesiuria è una rara causa di calcolosi. È presente solo nell’ 1% dei casi di stone formers come fattore isolato e nel 6-11% in concomitanza con altre cause. Il magnesio si combina con i sali di calcio e di ossalato e la sua presenza nelle urine agisce come fattore protettivo nei confronti della formazione di calcoli.
L’ipomagnesuria inoltre è spesso associata con l’ipocitraturia. Un basso livello di magnesio urinario può dipendere o da una ridotta assunzione di questo elemento con la dieta oppure con un suo ridotto assorbimento dall’intestino, come avviene nella diarrea cronica.
Calcoli Di Cistina (torna su)
La cistinuria è una patologia ereditaria autosomica recessiva caratterizzata da un difetto di riassorbimento di cistina nel rene. In realtà in questa patologia vi è il difetto di riassorbimento di tutti gli aminoacidi dibasici, che, oltre alla cistina, includono anche la lisina, l’arginina e l’ornitina. L’incidenza dei calcoli ai reni da cistina è molto rara: è compresa tra 1:1000 ed 1:17.000 a seconda delle casistiche. La cistinuria è causa del 10% dei casi di calcolosi pediatrica.
Calcoli Infettivi (torna su)
I calcoli infettivi sono composti principalmente da fosfato magnesio ammonio esaidrato ma possono contenere anche fosfato di calcio. Questo tipo di calcolosi viene comunemente denominato calcolosi da Struvite, dal nome del loro scopritore: lo scienziato von Struve. I calcoli di struvite sono causati dai batteri dotati di un enzima denominato “ureasi”, che possiede la capacità di scindere l’urea normalmente presente nelle urine umane.
I batteri che più frequentemente causano calcoli di struvite sono:
- Proteus mirabilis
- Klebsiella
- Pseudomonas
- Stafilocco
Il germe più comune è il proteus. L’E. coli, pur essendo il battere più frequentemente causa di infezioni urinarie, raramente è causa di calcoli. I batteri possono inoltre predisporre alla formazione di calcoli perché causano un danno diretto all’epitelio che riveste le vie urinarie ed aumentano pertanto l’aderenza dei cristalli. Dal momento che le donne sono maggiormente predisposte rispetto agli uomini alle infezioni urinarie, i calcoli infettivi sono più frequenti negli individui femminili con un rapporto di 2:1.
Altri Tipi Di Calcoli (torna su)
I calcoli di Xantina sono molto rari e vengono spesso confusi con quelli di acido urico perché entrambi questi tipi di calcoli sono radiotrasparenti. La loro formazione dipende da una rara malattia genetica che causa alterazione nel metabolismo della Xantina.
I calcoli di urato di ammonio rappresentano meno dell’ 1% ti tutti i tipi di calcolosi. Le potenziali cause di questo tipo di calcoli possono essere:
- abuso di lassativi
- infezioni urinarie ricorrenti
- calcolosi cronica da acido urico
- malattie infiammatorie intestinali
I calcoli da farmaci dipendono dalla precipitazione nelle urine del metabolismo di alcuni farmaci. In altri casi alcuni medicamenti possono provocare alterazioni metaboliche che predispongono alla calcolosi.
I farmaci potenziali responsabili di calcoli sono:
- Diuretici (furosemide e bumetanide)
- Inibitori dell’ anidrasi carbonica (acetazolamide, topiramato, zonisamide)
- Efedrina
- Triamterene
- Guafanesina
- Silicato
- Indinavir
Anomalie Anatomiche (torna su)
Alcune anomalie anatomiche che provocano una ostruzione parziale o totale delle vie urinarie possono predisporre alla formazione di calcoli.
La stenosi del giunto pielo-ureterale è un restringimento del tratto anatomico che congiunge la pelvi renale all’ uretere. Questa patologia causa una ostruzione parziale al deflusso di urina ed è corretta tramite approccio chirurgico di tipo laparoscopico.
Il rene a ferro di cavallo è un difetto anatomico congenito in cui si assiste alla fusione dei poli inferiori dei reni attraverso un istmo. Questa patologia, la cui prevalenza è dello 0,25%, è asintomatica in un terzo dei casi e viene scoperta comunemente eseguendo casualmente un esame radiologico . Il rene a ferro di cavallo favorisce la calcolosi renale, l’ostruzione del giunto pieloureterale, l’idronefrosi, il reflusso vescico-ureterale e la pielonefrite.
I diverticoli caliceali sono delle estroflessioni dei calici renali all’ interno dei quali si possono formare calcoli nel 40% dei casi.
Il rene a spugna midollare è una patologia cistica della porzione midollare renale in cui vi è la presenza di dilatazioni multiple dei dotti collettori.
Calcoli renali in gravidanza. Le donne in gravidanza sono affette da calcoli con una prevalenza che può variare da 1:250 a 1:3000 a seconda delle casistiche. Durante la gravidanza vi è un fisiologico aumento della filtrazione renale che porta ad un aumento nelle urine di calcio, sodio ed acido urico.
BIBLIOGRAFIA
- Barcelo, P., et al. Randomized double-blind study of potassium citrate in idiopathic hypocitraturic calcium nephrolithiasis. J Urol, 1993. 150: 1761.
- Bichler, K.H., et al. Urinary infection stones. Int J Antimicrob Agents, 2002. 19: 488.
- Biyani, C.S., et al. Cystinuria—diagnosis and management. EAU-EBU Update Series 2006. 4: 175.
- Borghi, L., et al. Randomized prospective study of a nonthiazide diuretic, indapamide, in preventing calcium stone recurrences. J Cardiovasc Pharmacol, 1993. 22 Suppl 6: S78.
- Borghi, L., et al. Urinary volume, water and recurrences in idiopathic calcium nephrolithiasis: a 5-year randomized prospective study. J Urol, 1996. 155: 839.
- Brocks, P., et al. Do thiazides prevent recurrent idiopathic renal calcium stones? Lancet, 1981. 2: 124.
- Cameron, M.A., et al. Uric acid nephrolithiasis. Urol Clin North Am, 2007. 34: 335.
- Chou, Y.H., et al. Clinical study of ammonium acid urate urolithiasis. Kaohsiung J Med Sci, 2012. 28: 259.
- Chow, G.K., et al. Medical treatment of cystinuria: results of contemporary clinical practice. J Urol, 1996. 156: 1576.
- Coe, F.L. Hyperuricosuric calcium oxalate nephrolithiasis. Adv Exp Med Biol, 1980. 128: 439.
- Coe, F.L., et al. Kidney stone disease. J Clin Invest, 2005. 115: 2598.
- Dello Strologo, L., et al. Comparison between SLC3A1 and SLC7A9 cystinuria patients and carriers: a need for a new classification. J Am Soc Nephrol, 2002. 13: 2547.
- Ettinger, B., et al. Chlorthalidone reduces calcium oxalate calculous recurrence but magnesium hydroxide does not. J Urol, 1988. 139: 679.
- Ettinger, B., et al. Potassium-magnesium citrate is an effective prophylaxis against recurrent calcium oxalate nephrolithiasis. J Urol, 1997. 158: 2069.
- Favus, M.J., et al. The effects of allopurinol treatment on stone formation on hyperuricosuric calcium oxalate stone-formers. Scand J Urol Nephrol Suppl, 1980. 53: 265.
- Fink, H.A., et al. Medical management to prevent recurrent nephrolithiasis in adults: a systematic review for an American College of Physicians Clinical Guideline. Ann Intern Med, 2013. 158: 535.
- Gettman, M.T., et al. Struvite stones: diagnosis and current treatment concepts. J Endourol, 1999. 13: 653.
- Goldfarb, D.S., et al. Randomized controlled trial of febuxostat versus allopurinol or placebo in individuals with higher urinary uric acid excretion and calcium stones. Clin J Am Soc Nephrol, 2013. 8: 1960.
- Griffith, D.P., et al. Randomized, double-blind trial of Lithostat (acetohydroxamic acid) in the palliative treatment of infection-induced urinary calculi. Eur Urol, 1991. 20: 243.
- Hesse A, et al. Urinary Stones: Diagnosis, Treatment and Prevention of Recurrence., In: Uric acid stones. 2002, S Karger AG,: Basel.
- Hesse, A., et al. Causes of phosphate stone formation and the importance of metaphylaxis by urinary acidification: a review. World J Urol, 1999. 17: 308.
- Hofbauer, J., et al. Alkali citrate prophylaxis in idiopathic recurrent calcium oxalate urolithiasis–a prospective randomized study. Br J Urol, 1994. 73: 362.
- Hoppe, B., et al. The primary hyperoxalurias. Kidney Int, 2009. 75: 1264.
- Hyperuricosuric calcium stone disease, In: Kidney Stones: Medical and Surgical Management, Coe FL, Pak CYC, Parks JH, Preminger GM, Eds. 1996, Lippincott-Raven: Philadelphia.
- Jarrar, K., et al. Struvite stones: long term follow up under metaphylaxis. Ann Urol (Paris), 1996. 30: 112.
- Johansson, G., et al. Effects of magnesium hydroxide in renal stone disease. J Am Coll Nutr, 1982. 1: 179.
- Khan, S.R., et al. Magnesium oxide administration and prevention of calcium oxalate nephrolithiasis. J Urol, 1993. 149: 412.
- Kramer, G., et al. Role of bacteria in the development of kidney stones. Curr Opin Urol, 2000. 10: 35.
- Laerum, E., et al. Thiazide prophylaxis of urolithiasis. A double-blind study in general practice. Acta Med Scand, 1984. 215: 383.
- Lojanapiwat, B., et al. Alkaline citrate reduces stone recurrence and regrowth after shockwave lithotripsy and percutaneous nephrolithotomy. Int Braz J Urol, 2011. 37: 611.
- Low, R.K., et al. Uric acid-related nephrolithiasis. Urol Clin North Am, 1997. 24: 135.
- Madore, F., et al. Nephrolithiasis and risk of hypertension. Am J Hypertens, 1998. 11: 46.
- Marchini, G.S., et al. Gout, stone composition and urinary stone risk: a matched case comparative study. J Urol, 2013. 189: 1334.
- Matlaga, B.R., et al. Drug-induced urinary calculi. Rev Urol, 2003. 5: 227.
- Mattle, D., et al. Preventive treatment of nephrolithiasis with alkali citrate–a critical review. Urol Res, 2005. 33: 73.
- Maxwell P.A. Genetic renal abnormalities. Medicine, 2007. 35: 386.
- McLean, R.J., et al. The ecology and pathogenicity of urease-producing bacteria in the urinary tract. Crit Rev Microbiol, 1988. 16: 37.
- Miano, R., et al. Stones and urinary tract infections. Urol Int, 2007. 79 Suppl 1: 32.
- millman, S., et al. Pathogenesis and clinical course of mixed calcium oxalate and uric acid nephrolithiasis. Kidney Int, 1982. 22: 366.
- Mollerup, C.L., et al. Risk of renal stone events in primary hyperparathyroidism before and after parathyroid surgery: controlled retrospective follow up study. Bmj, 2002. 325: 807.
- Mortensen, J.T., et al. Thiazides in the prophylactic treatment of recurrent idiopathic kidney stones. Int Urol Nephrol, 1986. 18: 265.
- Nayan, M., et al. Variations between two 24-hour urine collections in patients presenting to a tertiary stone clinic. Can Urol Assoc J, 2012. 6: 30.
- Ng, C.S., et al. Contemporary management of cystinuria. J Endourol, 1999. 13: 647.
- Nicar, M.J., et al. Use of potassium citrate as potassium supplement during thiazide therapy of calcium nephrolithiasis. J Urol, 1984. 131: 430.
- Norman, R.W., et al. When should patients with symptomatic urinary stone disease be evaluated metabolically? J Urol, 1984. 132: 1137.
- Nouvenne, A., et al. New pharmacologic approach to patients with idiopathic calcium nephrolithiasis and high uricosuria: Febuxostat vs allopurinol. A pilot study. Eur J Int Med . 24: e64.
- Pak, C.Y., et al. Biochemical distinction between hyperuricosuric calcium urolithiasis and gouty diathesis. Urology, 2002. 60: 789.
- Pak, C.Y., et al. Management of cystine nephrolithiasis with alpha-mercaptopropionylglycine. J Urol, 1986. 136: 1003.
- Pak, C.Y., et al. Mechanism for calcium urolithiasis among patients with hyperuricosuria: supersaturation of urine with respect to monosodium urate. J Clin Invest, 1977. 59: 426.
- Parks, J.H., et al. A single 24-hour urine collection is inadequate for the medical evaluation of nephrolithiasis. J Urol, 2002. 167: 1607.
- Pearle, M.S., et al. Meta-analysis of randomized trials for medical prevention of calcium oxalate nephrolithiasis. J Endourol, 1999. 13: 679.
- Phillips, R., et al. Citrate salts for preventing and treating calcium containing kidney stones in adults. Cochrane Database Syst Rev, 2015: CD010057.
- Pinheiro, V.B., et al. The effect of sodium bicarbonate upon urinary citrate excretion in calcium stone formers. Urology, 2013. 82: 33.
- Premgamone, A., et al. A long-term study on the efficacy of a herbal plant, Orthosiphon grandiflorus, and sodium potassium citrate in renal calculi treatment. Southeast Asian J Trop Med Public Health, 2001. 32: 654.
- Prien, E.L., Sr., et al. Magnesium oxide-pyridoxine therapy for recurrent calcium oxalate calculi. J Urol, 1974. 112: 509.
- Rizzato, G., et al. Nephrolithiasis as a presenting feature of chronic sarcoidosis: a prospective study. Sarcoidosis Vasc Diffuse Lung Dis, 1996. 13: 167.
- Rodgers AL, et al. What can it teach us?, In: Proceedings of Renal Stone Disease 1st Annual International Urolithiasis Research Symposium, 2-3 November 2006., Evan A.P., Lingeman J.E. Eds. 2007, American Institute of Physics: Melville, New York
- Rodman JS, et al. Diagnosis and treatment of uric acid calculi., In: Kidney Stones. Medical and Surgical Management, Coe FL, Pak CYC, Parks JH, Preminger GM., Eds. 1996, Lippincott-Raven: Philadelphia.
- Rogers, A., et al. Management of cystinuria. Urol Clin North Am, 2007. 34: 347.
- Sarica, K., et al. The effect of calcium channel blockers on stone regrowth and recurrence after shock wave lithotripsy. Urol Res, 2006. 34: 184.
- Shekarriz, B., et al. Uric acid nephrolithiasis: current concepts and controversies. J Urol, 2002. 168: 1307.
- Siener, R., et al. The role of overweight and obesity in calcium oxalate stone formation. Obes Res, 2004. 12: 106.
- Silverberg, S.J., et al. A 10-year prospective study of primary hyperparathyroidism with or without parathyroid surgery. N Engl J Med, 1999. 341: 1249.
- Soygur, T., et al. Effect of potassium citrate therapy on stone recurrence and residual fragments after shockwave lithotripsy in lower caliceal calcium oxalate urolithiasis: a randomized controlled trial. J Endourol, 2002. 16: 149.
- Takei, K., et al. Oral calcium supplement decreases urinary oxalate excretion in patients with enteric hyperoxaluria. Urol Int, 1998. 61: 192.
- Thompson, R.B., et al. Bacteriology of infected stones. Urology, 1973. 2: 627.
- Tiselius, H.G. Standardized estimate of the ion activity product of calcium oxalate in urine from renal stone formers. Eur Urol, 1989. 16: 48.
- Tiselius, H.G., et al. Effects of citrate on the different phases of calcium oxalate crystallization. Scanning Microsc, 1993. 7: 381.
- Urine evaluation (in: Evaluation of the stone former), in 2ND International Consultation on Stone Disease, H.M. Assimos D. Chew B, Hautmann R, Holmes R, Williams J, Wolf JS, Editor. 2007, Health Publications.
- Wagner, C.A., et al. Urinary pH and stone formation. J Nephrol, 2010. 23 Suppl 16: S165.
- Wall, I., et al. Long-term acidification of urine in patients treated for infected renal stones. Urol Int, 1990. 45: 336.
- Wong HY, et al. Medical management and prevention of struvite stones, in Kidney Stones: Medical and Surgical Management, Coe & F.M. FL, Pak CYC, Parks JH, Preminger GM., Editors. 1996, Lippincott-Raven: Philadelphia.
- Worcester, E.M., et al. New insights into the pathogenesis of idiopathic hypercalciuria. Semin Nephrol, 2008. 28: 120.

Specialista in Urologia ed Andrologia
Gallo Uro-Andrology Centre
Via Santa Lucia 97, 80132. Napoli
P.za del Corso 5, 84014, Nocera Inferiore (SA)
Mail: info@studiourologicogallo.it
Telefono: +390817649530 (fisso)
+393389838481 (mobile)
Sito Web: www.studiourologicogallo.it





